Your cart is currently empty!
FDA MoCRA 화장품 현대화 법
MoCRA

화장품 규제 현대화 법 (MoCRA) – FDA의 화장품 및 미용 산업에 대한 법적 권한과 영향
84년만에, FDA는 부실했던 화장품에 대한 규제를 재정비하고, 새롭고 현대화된 법안, MoCRA를 제안하는 중입니다.
MoCRA는 Modernization of Cosmetics Regulation Act의 약자로, 2022년 12월 29일에 제정된 미국 화장품 규제 개혁 법입니다. 이 법은 1938년 제정된 연방 식품, 의약품 및 화장품 법(FD&C Act) 이후 처음으로 화장품 규제를 크게 강화한 법으로, 소비자 안전을 보호하고 화장품 산업의 투명성을 높이는 것을 목표로 합니다.
2023년 11월 8일, FDA는 “화장품 제품 시설 등록 및 화장품 제품 목록 준수 정책”이라는 산업 지침을 발표했습니다. 이 지침은 FDA가 2024년 7월 1일까지 607조에 따른 화장품 제품 시설의 등록 요건을 집행하지 않을 것임을 설명합니다. 미국 내 유통을 위한 화장품 제품의 제조 또는 가공 시설을 소유하거나 운영하는 모든 사람은 해당 시설을 등록해야 합니다(FD&C 법 607(a)(1)(A) 조)
Overview-
MoCRA 준수의 필수성과 중요성
많은 기업들이 MoCRA등록을 완료하지 못해 판매 정지와 같은 큰 손실을 경험하고 있습니다.
미화 100만 달러 이하 매출의 브랜드와 생산시설에게는 MoCRA 섹션 606과 607이 면제 이지만, 많은 벤더들이 제품 안전성 증빙의 이유로 중금속 성분 테스트와 함께 제출을 요구 하고 있습니다.

MoCRA 리스팅/등록 기대 효과
소비자 신뢰 증대
제품이 FDA의 규제를 준수하고 정식으로 등록되어 있다는 사실은 소비자들에게 안정성과 품질에 대한 신뢰를 줍니다. 이는 브랜드 가치를 향상시키고 소비자 충성도를 높일 수 있습니다.
시장 접근성 향상
FDA에 제품을 등록함으로써, 화장품 기업은 미국 시장에 제품을 합법적으로 판매할 수 있는 자격을 얻습니다. 이는 특히 해외 제조업체에게 중요한 이점이 될 수 있으며, 미국 내에서의 사업 확장 기회를 제공합니다.
규제 준수를 통한 위험 관리
제품을 등록하면서 발생할 수 있는 법적 리스크를 줄일 수 있습니다. 규제 준수는 제품 리콜이나 법적 분쟁의 위험을 감소시켜, 기업이 안정적인 운영을 유지할 수 있도록 도와줍니다.
투명성 강화
FDA 제품 등록 과정에서 제품의 성분, 공급망 등에 대한 정보를 제공해야 하므로, 이는 기업의 운영 투명성을 증가시킵니다. 이러한 투명성은 소비자와 규제 기관 둘 다에게 긍정적으로 작용할 수 있습니다.
MoCRA 등록을 위한 핵심 역량
기존 VCRP 대비, 제품 리스팅 당 입력하는 정보가 많아 단순 서류 작업을 넘어
정확한 정보 검증과 제출이 요구 되며, FDA-INSIGHT의 역량과 함께
FDA의 불필요한 모니터링이나 오류를 줄일 수 있습니다.
제품 성분 보고
모든 화장품 제조업체는 제품에 사용된 모든 성분을 FDA에 보고해야 하며, 제품의 안전성과 효과를 입증할 수 있는 자료를 제공해야 합니다.
화장품의 성분 표시 규정
책임자 연락처, 성분표, 착향제, 알러젠 등 라벨링에 대해 세부 규칙이 제정되었습니다.
FDA의 화장품에 대한 감독 권한
FDA 요구/전달 사항에 대하여 통상 시정 계획을 15일 이내로 응답 해야 하므로 US Agent는 현지 책임자에게 빠르고 정확한 전달이 중요합니다.
유해사례 기록 관리 및 중대한 유해사례 보고
제품 사용과 관련된 모든 건강 관련 유해사례(adverse events) 기록을 6년(일부 소규모 기업의 경우 3년) 동안 유지해야 합니다.
착향제 알러젠 공개 규칙
FDA가 EU 요구사항 및 기타 국제 요구사항을 고려하여 공개 해야 하는 착향제 알러젠을 규칙을 정립할 예정입니다.
화장품의 리콜 절차
화장품이 안전하지 않거나 라벨링이 부적절한 경우 FDA는 제조업체에 리콜을 요청할 수 있습니다. 제조업체는 리콜 절차를 신속하게 진행해야 하며, 이 과정에서 FDA와 긴밀히 협력해야 합니다.
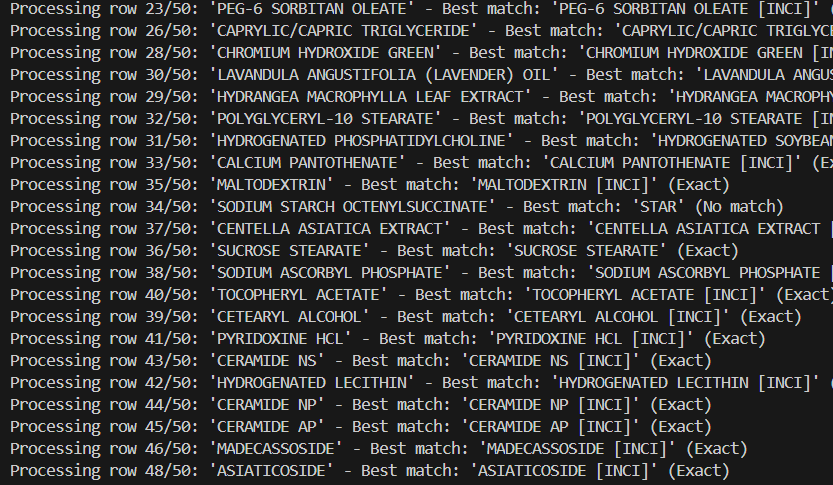
MoCRA 시행 전 자체 DB 및 검색/변환 시스템 구축
- 2024년 3월 기준, 963,792종 UNII 데이터베이스 대조 가능
- 대량의 제품 정보를 신속하고 정확하게 SPL(Structured Product Labeling) 보고 방식으로 변환
- 분자량, 이온 결합, 색상 등 성분명이 동일하나 성질이 다른 물질 구별 가능
- 제조사 및 브랜드가 정확한 성분 표기로 FDA 보고 가능
복잡한 규제, 고객들의 어려움을 깊이 있게 듣고 있습니다.
여러분의 소중한 비즈니스가 이 같은 어려움에 부딪히지 않도록,
저희 FDA-INSIGHT가 함께 하겠습니다.
MoCRA 보고 과정
1.자료 취합
2.필수 정보 등록 – DUNS Number & FEI 발급
3.자료 리뷰 – 성분 분석, UNII 변환 (필요시 UNII 등록)
4.SPL 포맷 등록 서류 변환 (1일)
5.FDA 보고 (5-7일)

